|
Redacción. Madrid
Investigadores del Instituto de Biotecnología y Biomedicina y del Departamento de Bioquímica y Biología Molecular de la Universidad Autónoma de Barcelona (UAB) han desarrollado y patentado un método con la levadura Saccharomyces cerevisiae para detectar en proteínas humanas la formación de pequeños grupos tóxicos de moléculas precursores de las fibras amiloides implicadas en enfermedades neurodegenerativas. El test permite validar también la eficacia de posibles compuestos que deshagan o inhiban estos agregados iniciales, y estudiar la potencialidad terapéutica, a nivel básico, de un gran número de moléculas.
Los agregados iniciales están formados por entre dos y veinte moléculas. Investigaciones recientes parecen indicar que su toxicidad es más elevada que la de las fibras amiloides, pero su estudio no resulta fácil porque son inestables y su formación es transitoria.
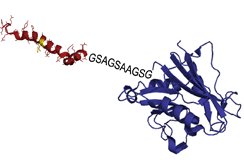
Fusión de AB42 (rojo) con DHFR (azul).
|
El método desarrollado por los investigadores de la UAB permite localizarlos y hacer un seguimiento del proceso de agregación de la proteína objeto de estudio in vivo, mediante técnicas de fluorescencia, sin tener que recurrir a métodos alternativos. El test permite también estudiar compuestos que inhiban estos agregados como un mecanismo potencialmente terapéutico que evite la formación posterior de las placas amiloides.
El sistema de cribado se ha llevado a cabo modificando genéticamente la levadura Saccharomyces cerevisiae, para vincular la agregación de proteínas humanas a la muerte celular. Se basa en la fusión del péptido humano objeto de estudio con la variante humana de una proteína indispensable para la supervivencia de la levadura modificada, la dihidrofolat reductasa (DHFR). La agregación del péptido inactiva la proteína DHFR y acaba provocando la muerte de la célula, proporcionando un sistema de detección de moléculas con tendencia a agregar y en el que cualquier compuesto que deshaga o inhiba esta agregación favorecerá la supervivencia celular.
Los investigadores han llevado a cabo su investigación con el péptido AB42 humano, principal causante de alzheimer. Para validar el test han probado varios compuestos que in vitro, en estudios sobre esta enfermedad, se habían mostrado efectivos contra la formación de agregados iniciales, fibras amiloides o ambos tipos de moléculas. El sistema solo se ha mostrado eficaz con los compuestos que afectan a los primeros, lo que hace de él un test muy específico para la detección inicial del proceso de agregación. La validación del sistema se ha hecho también con chaperonas, un grupo de proteínas que aumentan la disolución de los agregados proteicos y favorecen la supervivencia de la célula. Además del AB42, los investigadores también han validado el ensayo, en cuanto a la detección de agregados iniciales, con proteínas humanas implicadas en párkinson y enfermedad de Huntington.
Según Salvador Ventura, unos de los autores del trabajo, el sistema es fácil de utilizar, permite trabajar con rapidez y analizar de manera fiable la potencial eficacia terapéutica de una infinidad de compuestos en un primer nivel experimental. Sólo habría que automatizarlo, mediante placas que permitan el análisis simultáneo de más de cincuenta moléculas por ensayo, para la investigación básica. De momento, los investigadores ya lo han patentado.
|


